想象一个假设的情况,一个喜欢冰淇淋的孩子和他的两个朋友出去玩。起初,他和朋友A牵着手一起走,但朋友B很快就加入了,并把他的冰淇淋给了孩子。你认为该孩子会想牵谁的手?显然,朋友B!孩子们就是这样,他们倾向于向他们提供所爱东西的人。有趣的是,化学也处理这些类型的相互作用,这被称为反应。
- 图注:正在进行的化学反应
置换反应是一种化合物中一种元素取代另一种元素的化学反应。这可以是单置换反应或复分解反应(双置换反应)的形式。在单置换反应中,其中一种反应物比另一种反应物更具反应性,从而形成更稳定的产物。在双取代反应中,两种反应化合物中的元素都被取代。双重置换反应也会产生固体产物,称为沉淀。
什么是置换反应?
在深入研究这些亚型之前,让我们先探讨一下这个化学原理的基础知识。你见过生锈的铁棒吗?这类物体是化学反应的典型例子。将一种或多种物质转化为一种或多种不同物质的过程称为化学反应。发生变化的物质称为反应物,而形成的物质称为产物。在生锈的情况下,我们的反应物由空气中的铁和水蒸气表示。当这两种反应时,就会形成锈,这就是我们的生成物。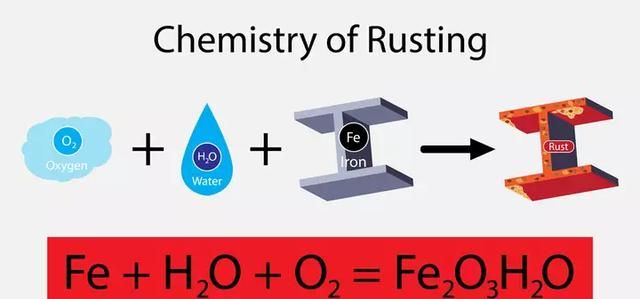
- 图注:生锈的化学作用
然而,为了对反应进行分类并使事情变得简单一些,我们将其分为特定的类别。在取代反应中,更多的活性元素取代化合物中活性较低的元素,形成稳定的产物。这些取代反应也称为置换反应。
什么是单置换反应?
既然你知道什么是置换反应,让我们看看它的一个亚型。考虑以下反应:A+BC–B+AC
这里,A是元素,BC是化合物,但A比化合物BC更具反应性。因此,当它们发生化学反应时,A将取代B,因为A更具反应性,形成化合物AC。B以元素或离子形式释放。在这种反应中,只有一种化合物发生了置换反应,因此被称为“单置换”。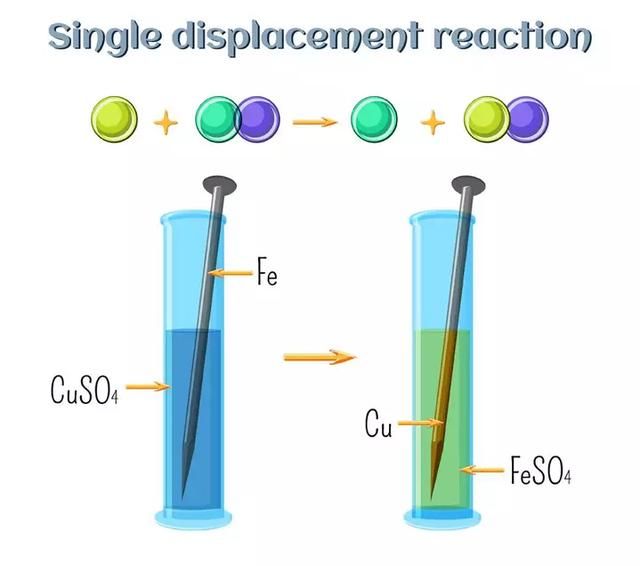
- 图注:单置换反应的图解表示
为了更好地理解这一点,让我们考虑以下示例:
Zn+CuCl2–ZnCl2+Cu
这种反应特别符合上述解释。锌比铜更具活性。因此,当它被添加到氯化铜溶液中时,它会取代铜并形成氯化锌。铜是以离子形式释放出来。这个反应也是阳离子置换的一个很好的例子。我们这么说是因为替换离子带正电荷,即2+。因此,它是一个阳离子。
Br2+2KI–2KBr+I2
类似地,当溴被添加到碘化钾溶液中时,它取代碘在化合物中的位置。结果,生成溴化钾,而碘分子被释放出来。这种反应之所以发生,是因为溴比碘更具活性,这就是它取代碘的原因。因为置换离子带有负电荷,这个反应是阴离子置换的一个例子。
什么是复分解反应(双置换反应)?
理解复分解反应最简单的方法是记住“交换伙伴”这个词。在分解反应中,两种反应化合物中的元素都被置换。在这里,两个离子化合物的部分被交换,形成两个新的化合物。让我们考虑以下反应:AB+CD–AC+BD
在这里,反应化合物中的元素交换它们的伙伴。在生成物中,A与C结合,B与D结合。因为置换发生在两个地方,所以称为双置换反应。双置换反应也称为复分解反应。通常,在这些反应中,当结合水溶液时,也会形成固体产物。这种产物称为沉淀,这种反应称为沉淀反应。
例如,看看这个反应:
AgNO3(aq)+NaCl(aq)AgCl(s)+NaNO3(aq)
当硝酸银水溶液与氯化钠水溶液混合时,形成硝酸钠溶液,而氯化银析出。很容易看出两种反应化合物中的元素都被取代了。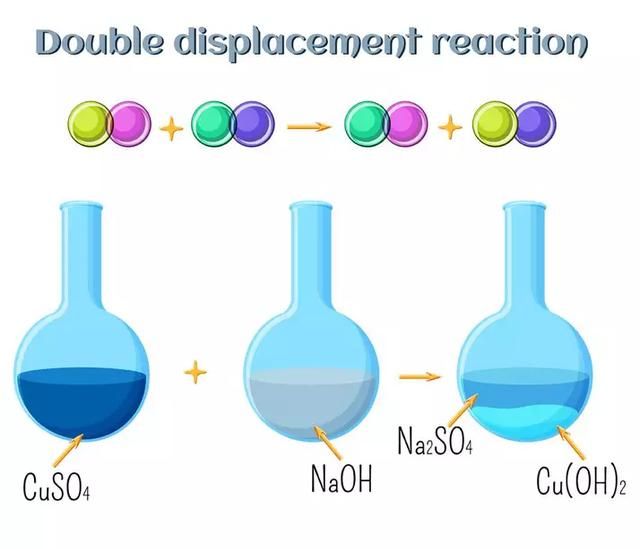
- 图注:复分解反应(双置换反应)反应的图解表示
总之,在单置换反应中,反应性更强的元素取代反应性较弱的化合物。另一方面,在复分解反应(双置换反应)中,两种反应化合物交换伙伴,最终形成全新的化合物!
一个化学反应的形成,主要有两种原因:一种是化学物质之间发生了电子的交换(化合价有变化),另一种是化学反应后有气体、沉淀物、弱电解质等的生成。而前者是化学反应的本质,后者是化学反应中比较特殊的一部分。大多数的化学反应属于前者,即发生了电子之间的交换,在化学上表现为有化学价的变化。
置换反应一定为氧化还原反应,它发生了化学价的变化。置换反应宏观上来看,是一种单质与化合物反应生成另外一种单质和化合物的化学反应。置换反应包括金属与金属盐的反应,金属与酸的反应等。可简记为AB+C=A+CB。
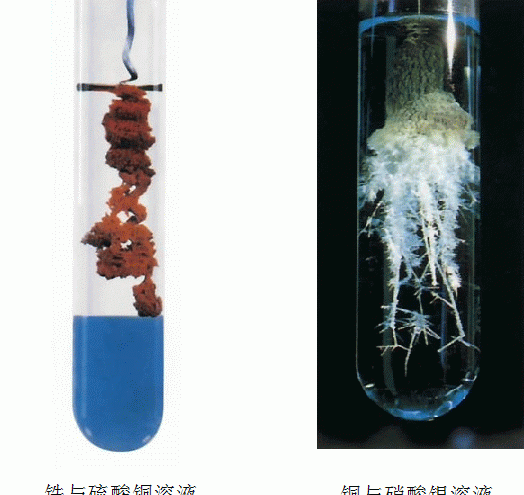
举一个讲解的例子来说明一下置换反应,也是在说明这种化学反应类型的本质。例如铁置换出硫酸铜的反应,Fe+Cu(2+)====Fe(2+)+Cu。这个反应中,铁失去了电子,铜得到了电子,说明铜比铁获得电子的能力强。就好比两个人打架,铜比较厉害,把铁的钱(电子)抢了过来。
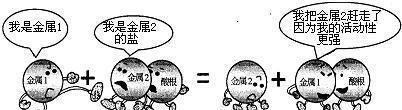
复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应。复分解反应的实质是发生复分解反应的两种物质在水溶液中交换离子,结合成难电离的物质——沉淀、气体或弱电解质(最常见的为水),使溶液中离子浓度降低,化学反应即向着离子浓度降低的方向进行。可简记为AB+CD→AD+CB。

我们举一个例子说明一下复分解反应的发生,例如HCl+NaOH====NaCl+H2O,这个反应生成了水是弱电解质。就好比原来H离子和CI离子是同桌,Na离子和OH根离子是同桌,但是它们一见面,H离子和OH根离子特别投缘,所以他们就重新换了同桌。
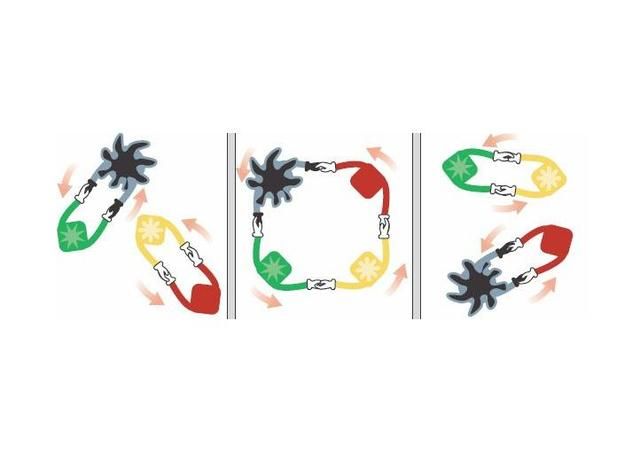
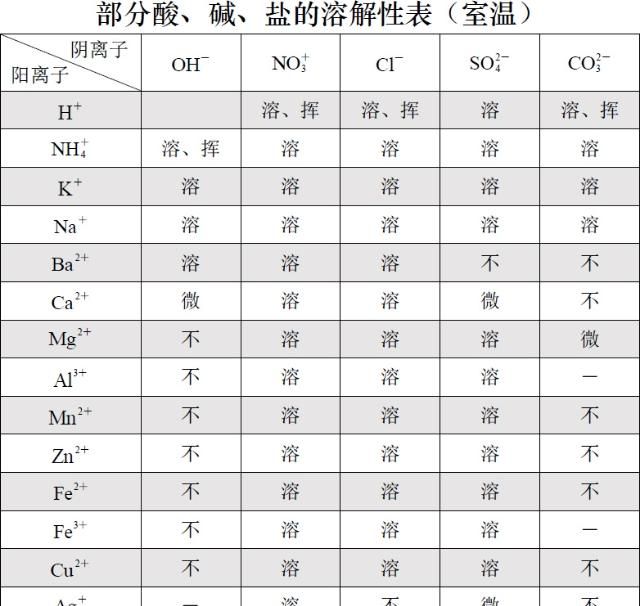
复分解反应是因为有难电离的物质生成,这样的化学反应比较少。大家只要查表就可以知道化学反应可不可以发生。附表如下:
原创文章,作者:小编,如若转载,请注明出处:http://www.ranqigaiguan.com/yhtg/3470.html








